Um professor de química fez uma demonstração em que produziu hidrogênio gasoso (H2 ) pela reação, a quente, de ácido clorídrico (HCℓ) com 6,75 g de alumínio sólido (Aℓ) sob forma de folhas amassadas.
Questões de Conhecimentos Gerais Unesp 2021-2
Um professor de química fez uma demonstração em que produziu hidrogênio gasoso (H2 ) pela reação, a quente, de ácido clorídrico (HCℓ) com 6,75 g de alumínio sólido (Aℓ) sob forma de folhas amassadas.
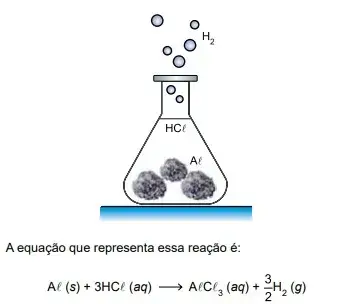
Considere que o hidrogênio seja um gás ideal, que a massa molar do alumínio seja 27 g/mol e que 1 L = 10–3 m³. Adote para a constante universal do gases o valor R = 8 J/(mol · K). Supondo que todo o gás hidrogênio produzido nessa reação seja armazenado a uma temperatura constante de 27 ºC em um recipiente rígido de volume 10 L, a quantidade de hidrogênio produzida nessas condições ficaria submetida a uma pressão de
- 6 × 104 N/m².
- 8 × 104 N/m².
- 5 × 104 N/m².
- 9 × 104 N/m².
- 4 × 104 N/m².